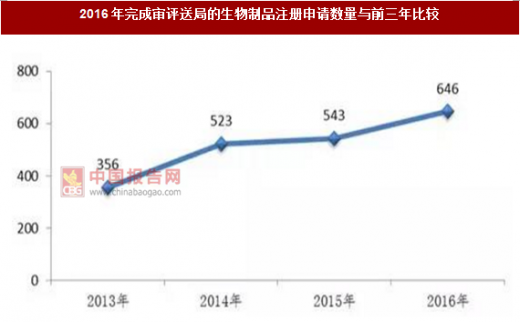
2016年,药审中心完成审评并呈送总局审批的生物制品注册申请共646件,另有完成审评因申报资料缺陷等待申请人回复补充资料注册申请108件。2016年完成审评送局的生物制品注册申请数量与前三年比较详见图。
2016年完成审评的生物制品各类注册申请数量详见表。
参考中国报告网发布《2017-2022年中国生物制品市场产销调研及十三五市场商机分析报告》
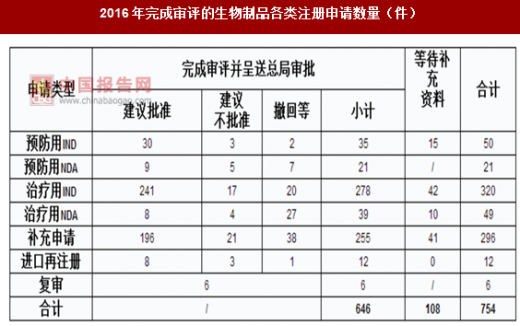
注:“预防用IND”为预防用生物制品IND申请,“预防用NDA”为预防用生物制品NDA,“治疗用IND”为治疗用生物制品IND申请,“治疗用NDA”为治疗用生物制品NDA。
2016年,药审中心完成审评送局的生物制品各类注册申请数量与前三年比较详见图。
2016年完成审评送局的生物制品注册申请数量与前三年比较

资料来源:中国报告网整理
2016年完成审评的生物制品各类注册申请数量详见表。
参考中国报告网发布《2017-2022年中国生物制品市场产销调研及十三五市场商机分析报告》
2016年完成审评的生物制品各类注册申请数量(件)

注:“预防用IND”为预防用生物制品IND申请,“预防用NDA”为预防用生物制品NDA,“治疗用IND”为治疗用生物制品IND申请,“治疗用NDA”为治疗用生物制品NDA。
资料来源:中国报告网整理
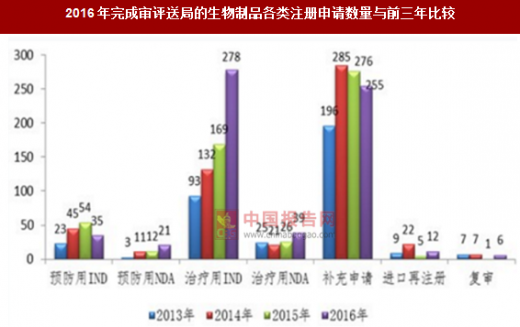
2016年,药审中心完成审评送局的生物制品各类注册申请数量与前三年比较详见图。
2016年完成审评送局的生物制品各类注册申请数量与前三年比较

资料来源:中国报告网整理
资料来源:中国报告网整理,转载请注明出处(GQ)
更多好文每日分享,欢迎关注公众号


【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。